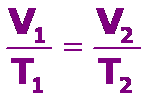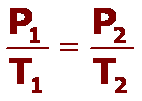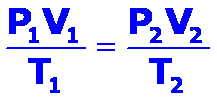ECUACIÓN DEL ESTADO GASEO
Una ecuación de estado es una ecuación que relaciona, para un sistema en equilibrio termodinámico, las variables de estado que lo describen. Tiene la forma general:
No existe una única ecuación de estado que describa el comportamiento de todas las sustancias para todas las condiciones de presión y temperatura.
Ecuación de estado de un gas ideal
La ecuación de estado más sencilla es aquella que describe el comportamiento de un gas cuando éste se encuentra a una presión baja y a una temperatura alta. En estas condiciones la densidad del gas es muy baja, por lo que pueden hacerse las siguientes aproximaciones:
- no hay interacciones entre las moléculas del gas,
- el volumen de las moléculas es nulo.
La ecuación de estado que describe un gas en estas condiciones se llama ecuación de estado de un gas ideal.
La ecuación de estado de un gas ideal es el resultado de combinar dos leyes empíricas válidas para gases muy diluidos: la ley de Boyle y la ley de Charles.
Ley de Boyle
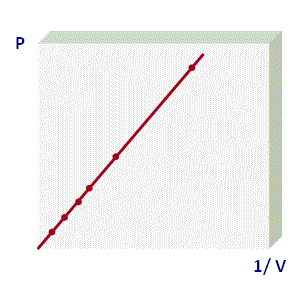
La ley de Boyle (1662) da una relación entre la presión de un gas y el volumen que ocupa a temperatura constante. Dicha ley establece que el producto de la presión por el volumen de un gas a temperatura constante es constante. Matemáticamente:
Ley de Charles
La ley de Charles (1787) establece que, a presión constante, el cociente entre el volumen que ocupa un gas y su temperatura, expresada en kelvin (K), es una constante.
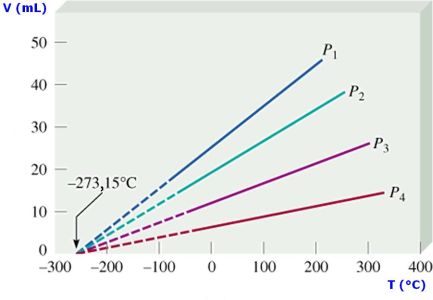
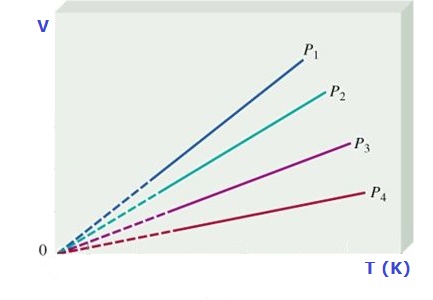
En la siguiente figura se ha representado el volumen que ocupa un gas para distintas temperaturas a presión constante:
La recta representada en la figura es independiente del gas encerrado en el recipiente, y corta con el eje horizontal a una temperatura (en oC) aproximadamente igual a - 273 oC. Como se observa en la gráfica, un gas a una temperatura inferior ocuparía un volumen negativo, por lo que no pueden existir temperaturas inferiores.
Este valor de la temperatura se emplea para definir el cero en la escala absoluta (o Kelvin) de temperaturas (pinchar el enlace anterior para más información).
Matemáticamente, la ley de Charles se expresa:
Combinando en una sola ecuación la ley de Boyle y la ley de Charles se obtiene:
Para un mol de gas, la constante que aparece en el segundo miembro de la ecuación anterior es la constante universal de los gases ideales R, por lo que la ecuación de estado de un gas ideal es:
donde n es el número de moles.
El valor de R en el Sistema Internacional es:
Isotermas de un gas ideal
La ecuación de estado de un gas ideal depende de tres variables (p, V, T), pero es posible representarla en dos dimensiones con ayuda del diagrama de Clapeyron odiagrama p - V. Si en la ecuación de estado de un gas ideal se fija el valor de la temperatura (por ejemplo T1), la ecuación resultante es:
que es la ecuación de una hipérbola. Gráficamente,
Cada valor de la temperatura sustituido en la ecuación de estado da lugar a una hipérbola. Por construcción, todos los puntos de una misma hipérbola corresponden a estados en que el gas ideal se encuentra a la misma temperatura, por lo que se denominan isotermas. Cuanto mayor es la temperatura, más arriba en el diagrama de Clapeyron se encontrará su isoterma correspondiente.