Leyes de los gases ideales
Gas ideal: es el comportamiento que presentan aquellos gases cuyas moléculas no interactúan entre si y se mueven aleatoriamente. En condiciones normales y en condiciones estándar, la mayoría de los gases presentan comportamiento de gases ideales.
Ley de Boyle
Si se reduce la presión sobre un globo, éste se expande, es decir aumenta su volumen, siendo ésta la razón por la que los globos meteorológicos se expanden a medida que se elevan en la atmósfera. Por otro lado, cuando un volumen de un gas se comprime, la presión del gas aumenta. El químico Robert Boyle (1627 - 1697) fue el primero en investigar la relación entre la presión de un gas y su volumen.
La ley de Boyle, que resume estas observaciones, establece que: el volumen de una determinada cantidad de gas, que se mantiene a temperatura constante, es inversamente proporcional a la presión que ejerce, lo que se resume en la siguiente expresión:
P.V = constante o P = 1 / V
y se pueden representar gráficamente como:

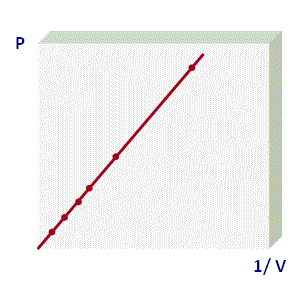
La forma que más utilizamos para representar la Ley de Boyle corresponde a la primera gráfica, donde se muestra a un rama de una hipérbola equilátera y podemos usar la siguiente expresión para determinar los valores de dos puntos de la gráfica:
P1 . V1 = P2 . V2
Este tipo de gráficos se denominan isotermas, por lo que a los procesos que cumplen con la Ley de Boyle se les denomina procesos isotérmicos. Para visualizar un video que muestra un experimento de la ley de Boyle.
 | Recuerda Para que se cumpla la Ley de Boyle es importante que permanezcan constantes el número de moles del gas, n, y la temperatura de trabajo, T. |
Ley de Charles
Cuando se calienta el aire contenido en los globos aerostáticos éstos se elevan, porque el gas se expande. El aire caliente que está dentro del globo es menos denso que el aire frío del entorno, a la misma presión, la diferencia de densidad hace que el globo ascienda. Similarmente, si un globo se enfría, éste se encoge, reduce su volumen. La relación entre la temperatura y el volumen fue enunciada por el científico francés J. Charles (1746 - 1823), utilizando muchos de los experimentos realizados por J. Gay Lussac (1778 - 1823).
La ley de Charles y Gay Lussac se resume en: el volumen de una determinada cantidad de gas que se mantiene apresión constante, es directamente proporcional a su temperatura absoluta, que se expresa como:

y gráficamente se representa como:
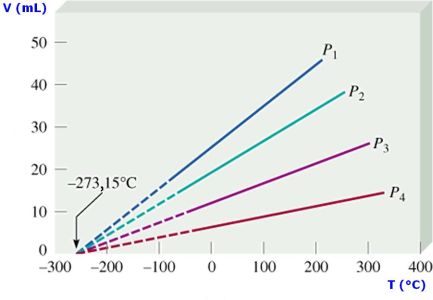
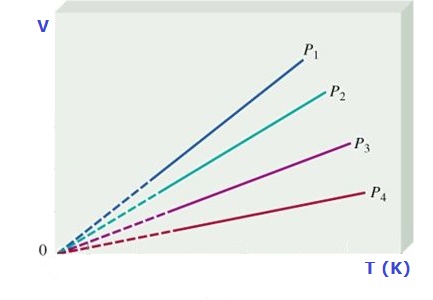
Debemos tener presente que la temperatura se DEBE expresar en grados Kelvin, K. Para determinar los valores entre dos puntos cualesquiera de la recta podemos usar:
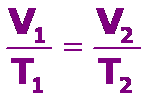
Los procesos que se realizan a presión constante se denominan procesos isobáricos.
Análogamente, la presión de una determinada cantidad de gas que se mantiene a volumen constante, es directamente proporcional a su temperatura absoluta, que se expresa como:

Los procesos que se producen a volumen constante se denominan procesos isocóricos. Para determinar los valores entre dos estados podemos usar:
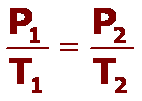
Ley de Gay-Lussac
Relación entre la presión y la temperatura de un gas cuando el volumen es constante
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800.
Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
La presión del gas es directamente proporcional a su temperatura:
•Si aumentamos la temperatura, aumentará la presión.
•Si disminuimos la temperatura, disminuirá la presión. |
¿Por qué ocurre esto?
Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:

(el cociente entre la presión y la temperatura es constante)
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:

Que es otra manera de expresar la ley de Gay-Lussac.
Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta. Al igual que en la ley de Charles, las temperaturas han de expresarse en Kelvin.
Ejemplo:
Cierto volumen de un gas se encuentra a una presión de 970 mmHg cuando su temperatura es de 25.0°C. ¿A qué temperatura deberá estar para que su presión sea 760 mmHg?
Solución: Primero expresamos la temperatura en kelvin:
T1 = (25 + 273) K= 298 K
Ahora sustituimos los datos en la ecuación:

970 mmHg
|
760 mmHg
| |
------------
|
=
|
------------
|
298 K
|
T2
|
Si despejas T2 obtendrás que la nueva temperatura deberá ser 233.5 K o lo que es lo mismo -39.5 °C.
Ley de los cambios triples
Al combinar las leyes mencionadas se obtiene la ley combinada de los gases ideales o ley de los cambios triples, que establece que para una determinada cantidad de gas se cumple:

Para determinar los valores entre dos estados diferentes podemos emplear:
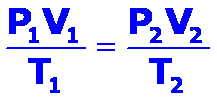
 | Recuerda:
|
Ley de Avogadro
A medida que agregamos gas a un globo, éste se expande, por lo tanto el volumen de un gas depende no sólo de la presión y la temperatura, sino también de la cantidad de gas.
La relación entre la cantidad de un gas y su volumen fue enunciada por Amadeus Avogadro (1778 - 1850), después de los experimentos realizados años antes por Gay - Lussac.
La ley de Avogadro establece que el volumen de un gas mantenido a temperatura y presión constantes, es directamente proporcional al número de moles del gas presentes:

Para determinar los valores para dos estados diferentes podemos usar:
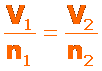
También podemos expresarlo en términos de: la presión de un gas mantenido a temperatura y volumen constantes, es directamente proporcional al número de moles del gas presentes:
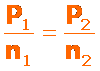
No hay comentarios:
Publicar un comentario